编辑|星星
«——【·前言·】——»
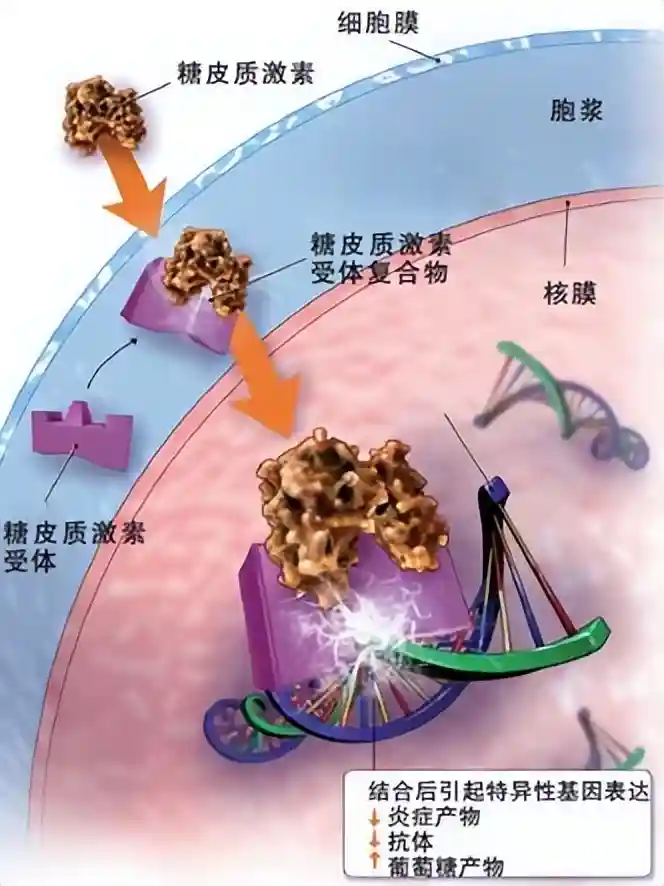
糖皮质激素受体(GR)是一种核受体,它在染色质建构和基因表达调控中与NIPBL发生相互作用,从而调节特定基因的表达过程。
然而,这些糖皮质激素受体亚基的相当大一部分(约60%至80%)与染色质无直接关联,至今,关于转录机制与内聚素复合物之间相互作用的机制仍不清晰。
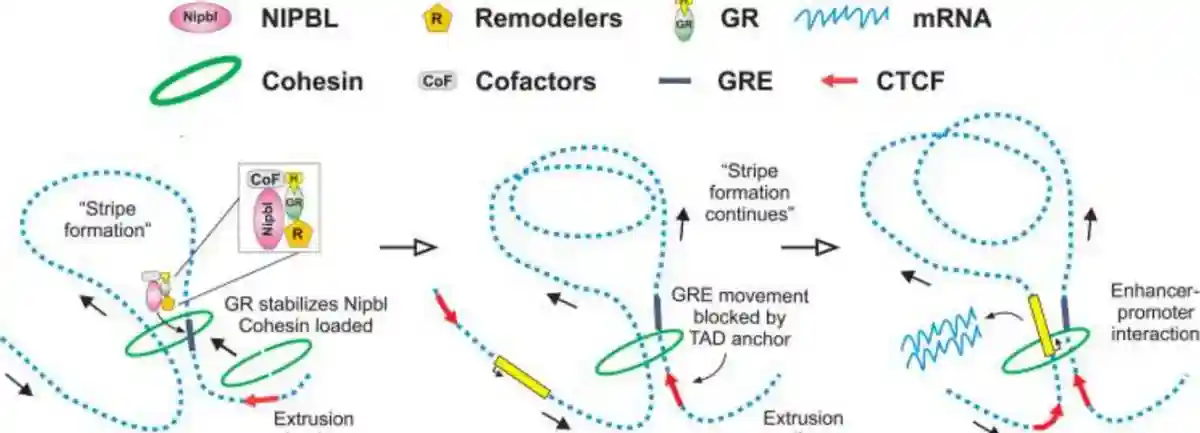
我们的研究表明,与染色质结合的糖皮质激素受体(GR)和粘连蛋白加载器NIPBL之间存在相互作用。
通过糖皮质激素的处理,NIPBL被引导到增强子区域,从而促进内聚素复合物与染色质的结合。
通过对基因调控网络的深入探索,揭示更多关于基因调控调节机制的细节,也适用于其他能够与NIPBL相互作用的转录调节因子。
«——【·iRNA转染·】——»
乳腺细胞在改良的Dulbecco鹰培养基(DMEM)和含有10%胎牛血清(FBS)的条件下进行生长。
同时添加丙酮酸钠、L-谷氨酰胺和非必需氨基酸,HCT116RAD21mAID细胞则在添加有10%木炭剥离胎牛血清(CSS)和L-谷氨酰胺的McCoy培养基中培养。

AML细胞在添加有20%FBS、丙酮酸、L-谷氨酰胺和必需氨基酸的RPMI培养基中生长,在进行每次100nM地塞米松治疗实验之前,所有细胞都在CSS中培养48小时。
为了有效地进行基因敲低,我们在对数生长期间,通过电穿孔(电压:5V,脉冲持续时间:3134ms,共三次脉冲)将10个细胞的总数达到140万个。
每个siRNA(针对NIPBL、SMC1或RAD21)使用10μg,电穿孔后的48小时和72小时,在细胞中加入载体或地塞米松进行处理。
在载体或地塞米松处理后,我们使用Macherey-Nagel试剂盒提取新合成的RNA,Bio-Rad互补DNA合成试剂盒将1μg的RNA逆转录,再使用Bio-Rad的SYBR-Green预混液进行qPCR分析。
«——【·邻近连接测定·】——»
将哺乳动物细胞接种到386孔板中,然后进行邻近连接测定。
使用4%多聚甲醛固定细胞,固定时间为20分钟,使用含有0.5%TritonX-100的PBS溶液进行透化处理,透化时间为20分钟。
在室温下,使用含有3%牛血清白蛋白和0.05%TritonX-100的PBS溶液对细胞进行封闭处理,封闭时间为一小时。
«——【·免疫沉淀·】——»
使用EtOH或地塞米松(20nM)处理约一百万个细胞,2%多聚甲醛固定细胞的固定时间为1分钟,用PBS洗涤细胞三次。
将细胞与裂解缓冲液在冰上孵育一小时,进行超声处理,以获得平均长度为500bp的DNA片段。
为了实现这一目标,将裂解物稀释,并在4°C条件下,将其与GR抗体预孵育的微球一起孵育过夜,在依次使用低盐、高盐、LiCl和最后的TE缓冲液洗涤磁珠后。
将磁珠在1×Laemmli缓冲液中进行洗脱/变性,在10°C条件下孵育95分钟,洗脱的蛋白质加载到预制的3至8%三乙酸酯凝胶上,蛋白质转移到聚偏二氟乙烯膜上进行蛋白质印迹,
«——【·糖皮质激素受体·】——»
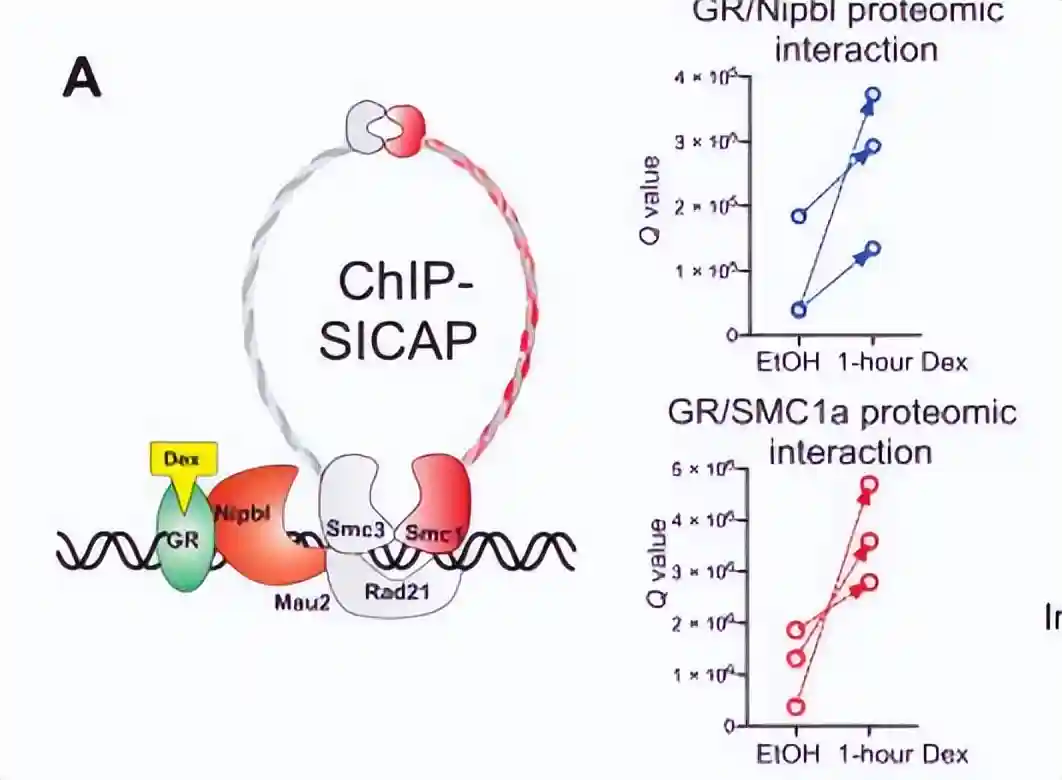
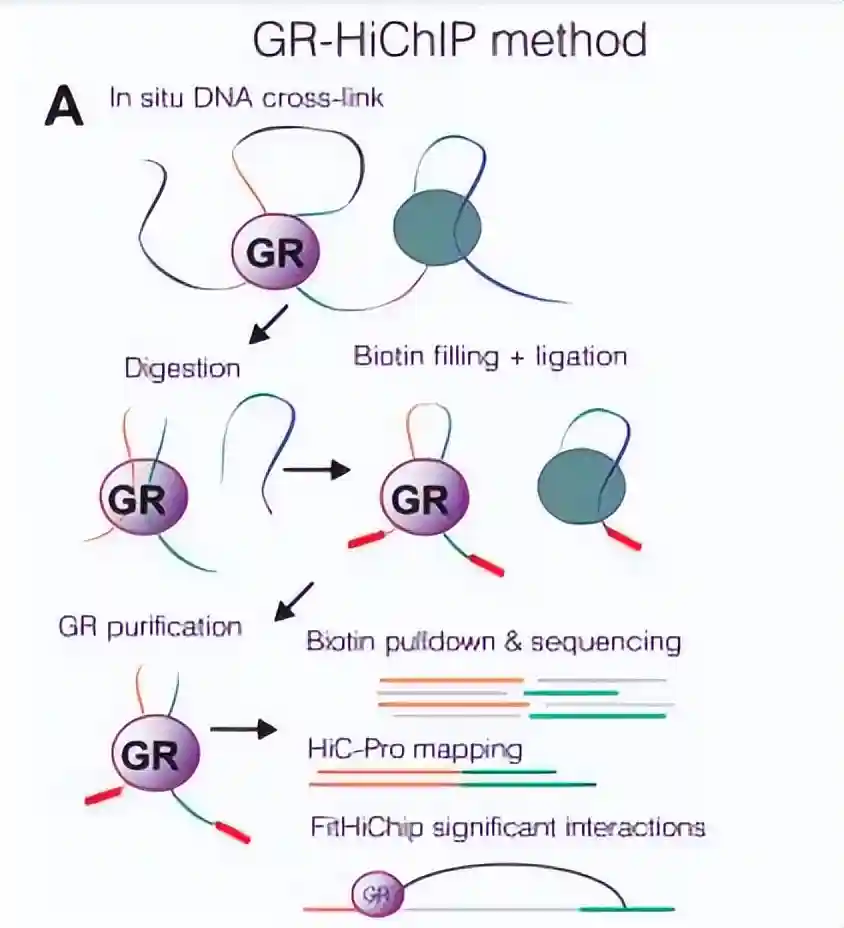
为了在染色质水平上发现糖皮质激素受体(GR)的新型相互作用,我们使用地塞米松处理或未处理的小鼠细胞,进行了定量无标记质谱(MS)和染色质免疫沉淀选择性分离染色质相关蛋白(ChIP-SICAP)实验。
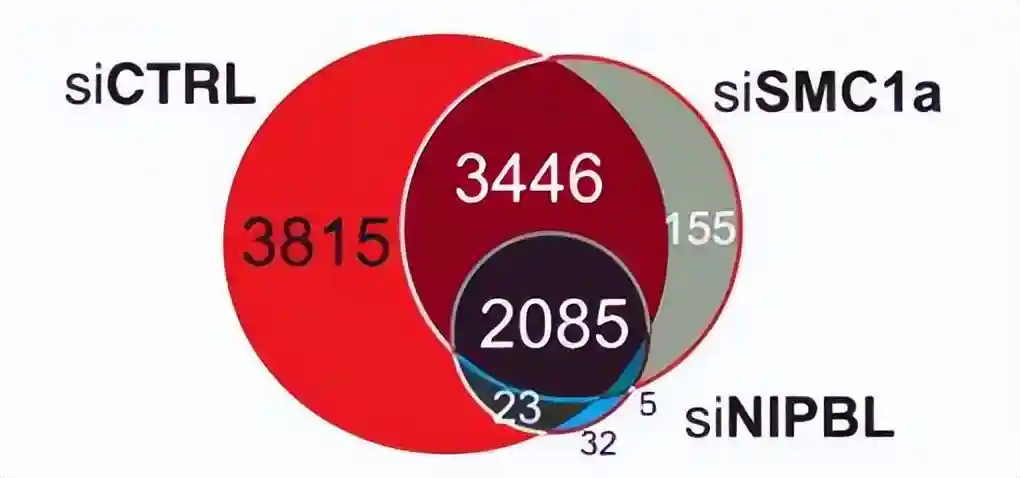
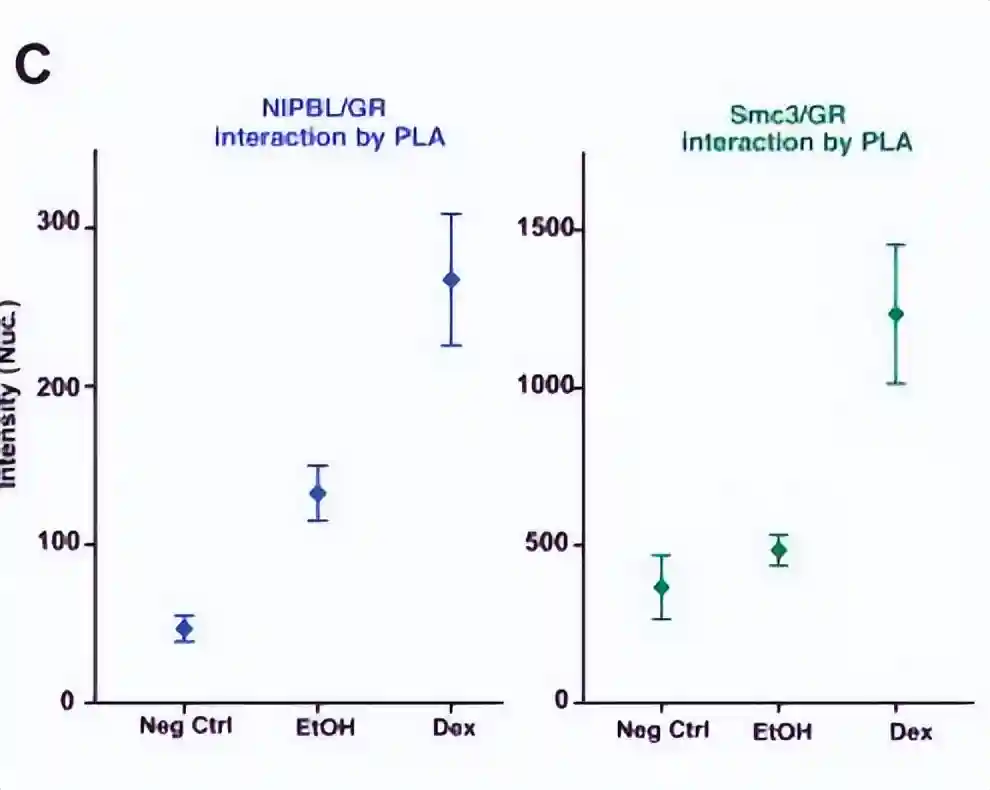
发现凝聚素加载器NIPBL和粘连素亚基SMC1a与染色质结合的GR发生相互作用。
这一结果通过独立的方法,包括免疫沉淀和邻近连接测定进行了证实,显示了内源性GR、NIPBL和凝聚素复合物的存在。
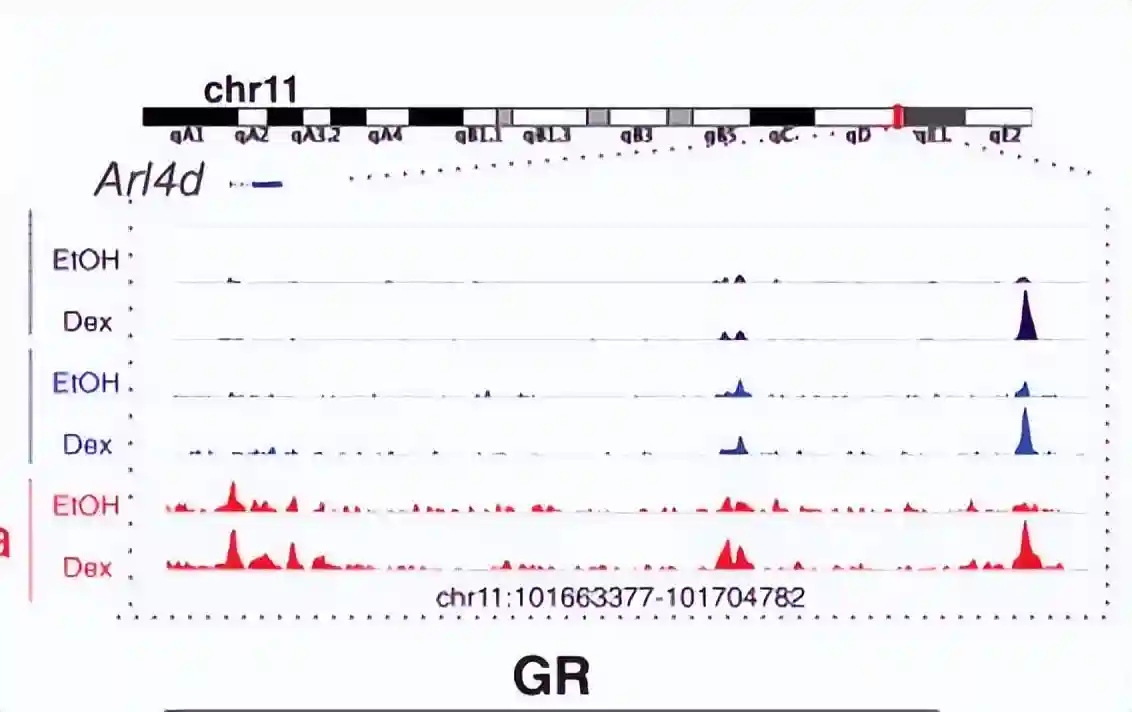
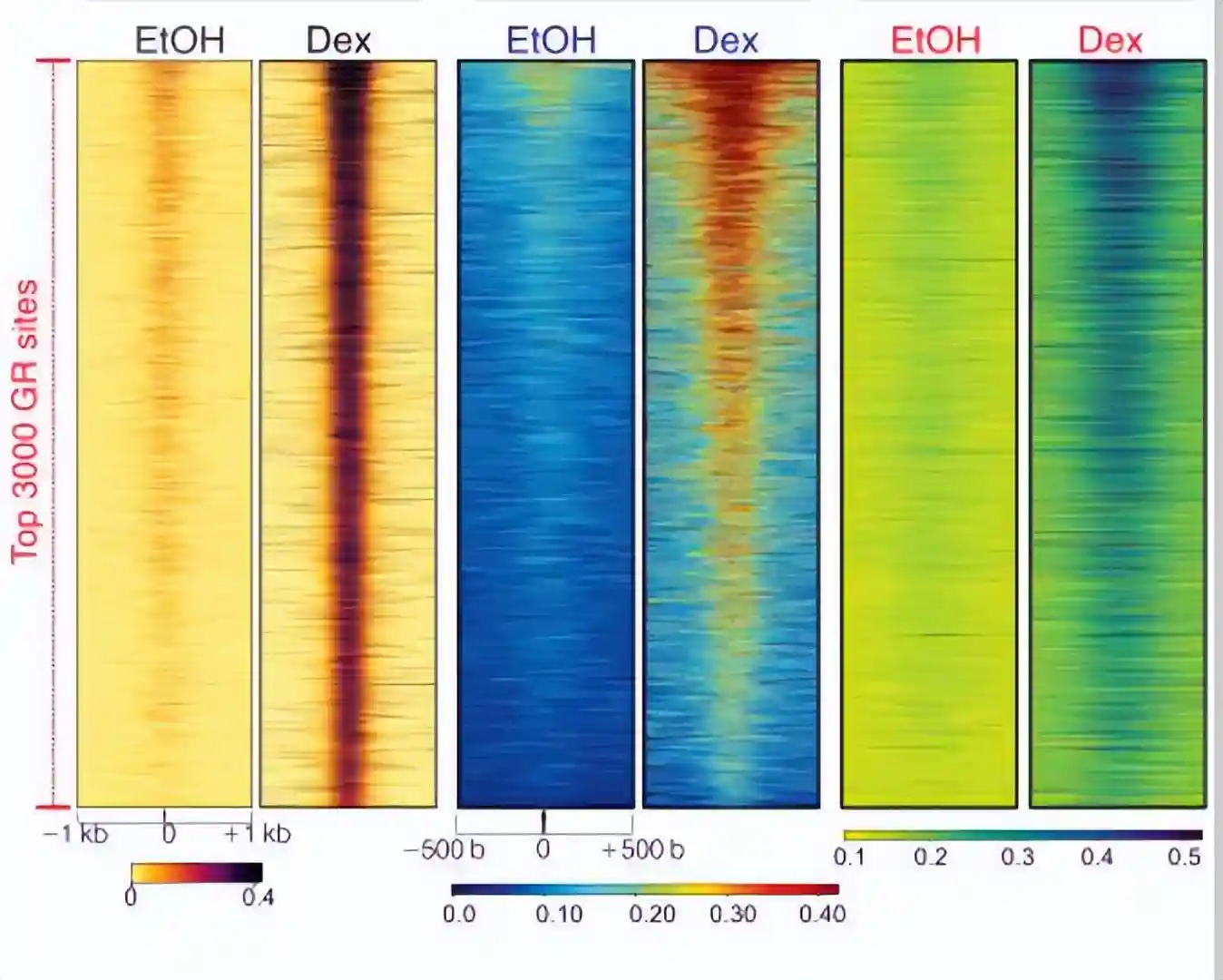
为了研究NIPBL-GR相互作用是否会在激素激活后增加染色质结合,在地塞米松处理前后分别对NIPBL和SMC1a进行了两次ChIP测序的生物学重复。
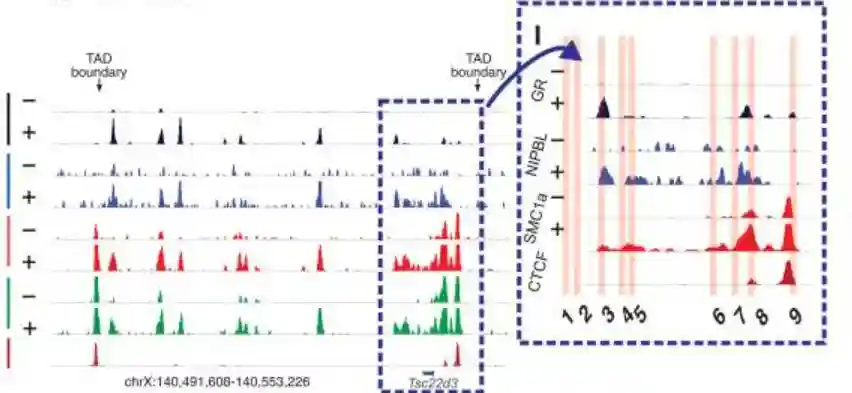
ChIP-seq分析结果表明,在处理地塞米松1小时后,GR结合的染色质元件上,NIPBL和SMC1a的结合增加。
这些数据表明,类固醇激素受体GR在染色质水平上与凝聚素加载器NIPBL和粘连素亚基SMC1a相互作用,以激素依赖性方式促进GR位点的粘连蛋白染色质结合。
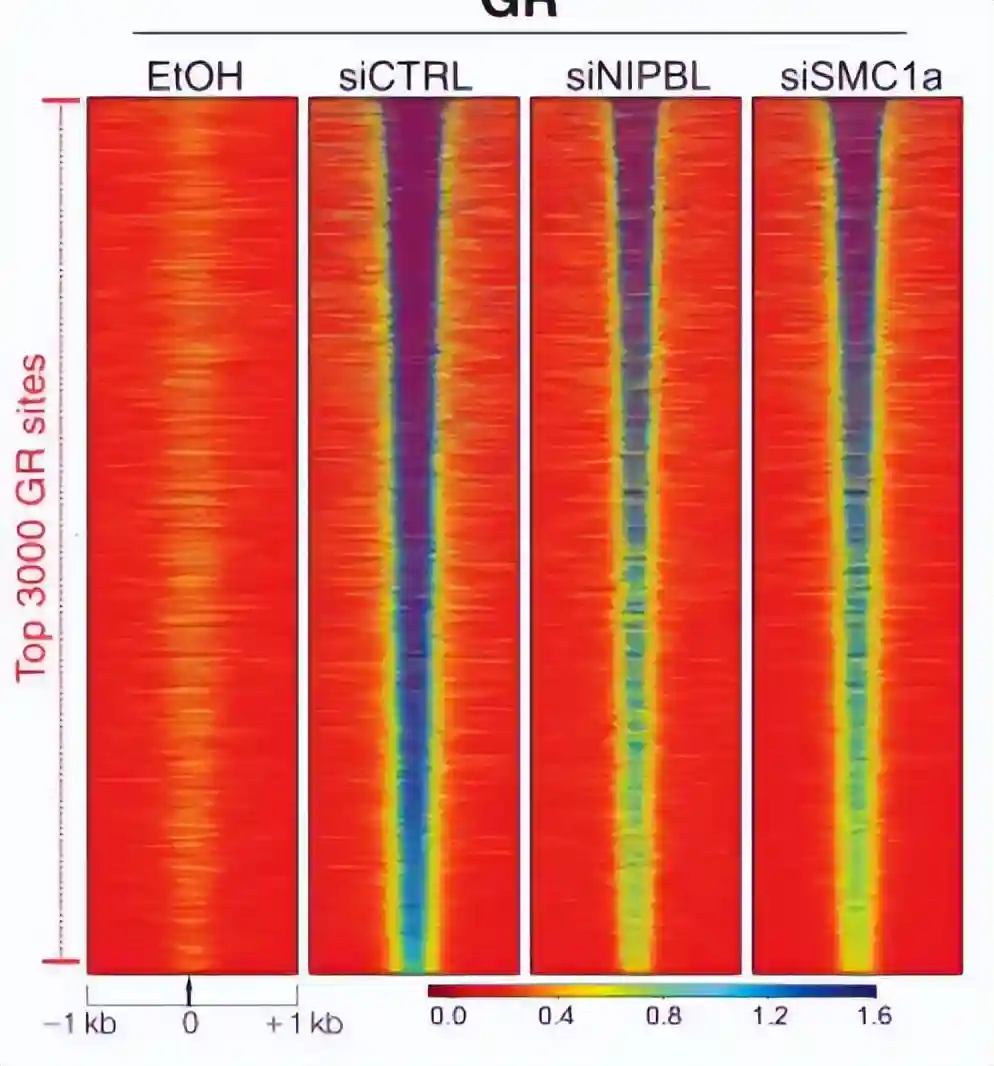
为了评估这种相互作用对GR染色质结合的重要性,我们对NIPBL和SMC1a进行了GRChIP-seq在敲低情况下的实验。
使用小干扰RNA(siRNA)在乳腺细胞中分别对NIPBL和SMC1A进行敲低。
通过蛋白质印迹法评估了siRNA转染72小时后,NIPBL和核心凝聚素亚基SMC1a的有效降低,NIPBL缺失降低了GR与染色质的结合,导致GR染色质位点的数量和GR结合的强度都受到严重影响。
与我们的siNIPBL结果一致,SMC1A消耗(经过72小时的siRNA处理)显著降低了GR与染色质的结合。
染色质分数数据清楚地显示,在敲低NIPBL和SMC1a后,GR在染色质的积累减少,其中NIPBL-粘连蛋白复合物与转录调节因子结合,以诱导远程基因调控。
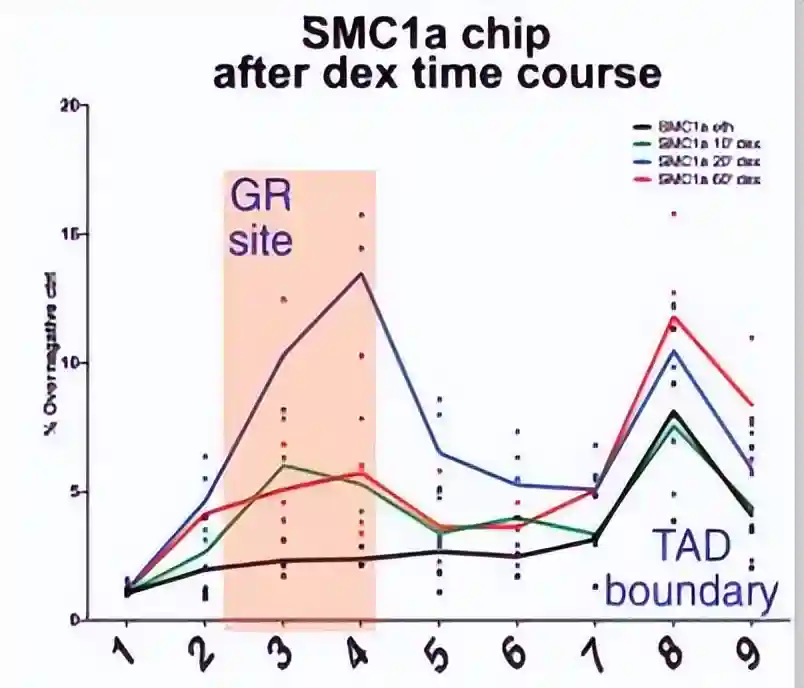
通过对CTCF基序取向进行分析,我们确定了TAD锚的位置,观察到GR主要结合在TAD锚附近。
为了测试GR是否诱导粘连蛋白在TAD边界停滞,我们对靠近GR结合位点的TAD边界与远离GR峰的TAD边界的粘连蛋白富集进行了量化。
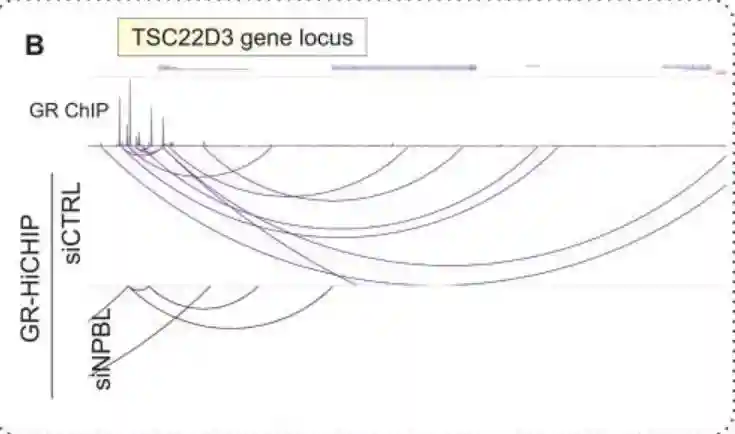
为了验证这一凝聚素加载模式,重复了这一测定法,我们研究了多个由长程相互作用调节的GR靶基因的染色质景观。
大多数GR结合的增强子显示,在20分钟地塞米松处理后,与1分钟相比,粘连蛋白亚基SMC60A在GR结合增强子上急剧富集。
而在60分钟后,GR结合增强子的富集程度减少,但在附近的TAD边界仍然非常显著。

这些数据表明,GR与NIPBL的直接相互作用,以及可能的其他转录因子,可以促进增强子位点的粘连蛋白结合。
«——【·介导长程基因·】——»
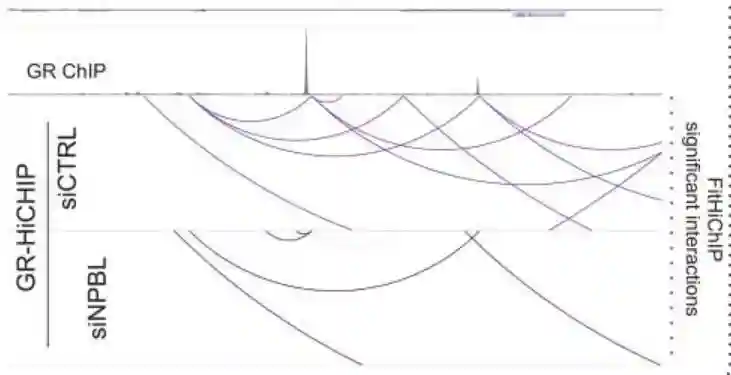
为了理解糖皮质激素受体(GR)和凝聚素加载器NIPBL如何介导长程基因相互作用,进行了对照组和NIPBL敲低细胞的两个生物学重复的Micro-C实验。
我们选择了Micro-C方法,因为与原位Hi-C相比,它具有重要优势,即利用微球菌核酸酶可以提供更高的分辨率。
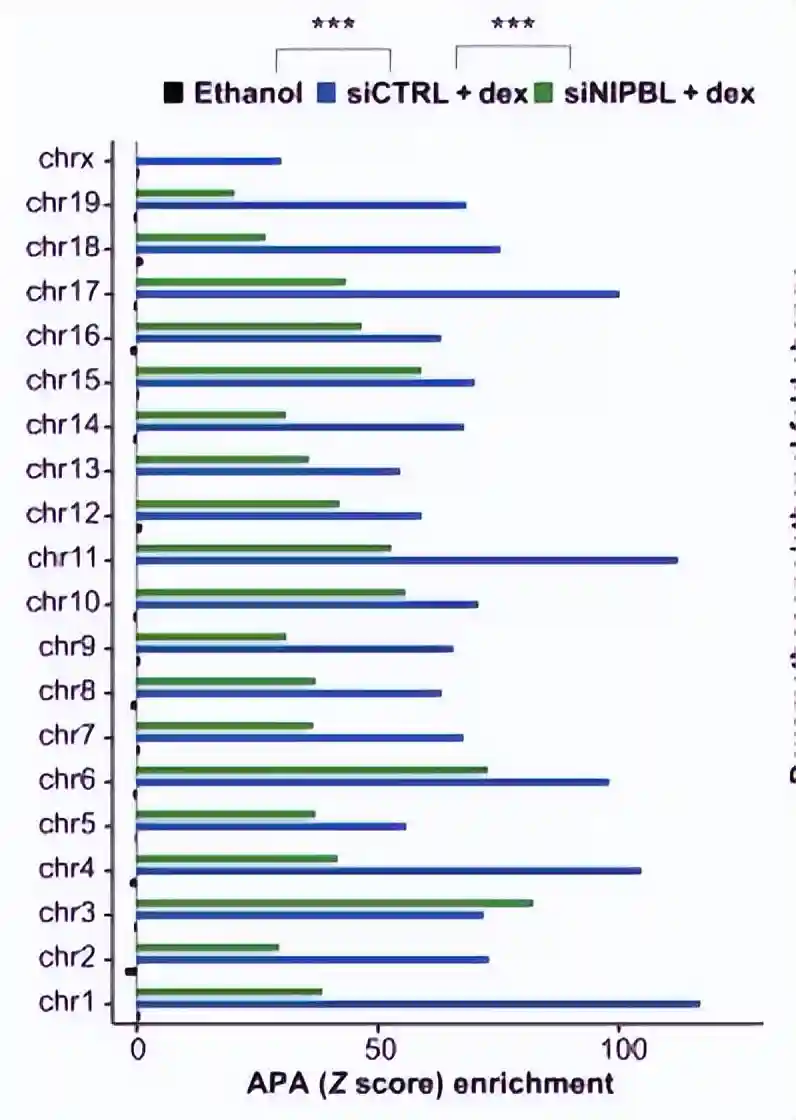
在过滤掉重复的低计数读数后,siCtrl对照细胞中发现了29,674个环,地塞米松处理后的细胞中总共有22,573个环。
在这一部分中,有2,650个相互作用(占总数的12%)代表了地塞米松诱导的新环,而6,404个相互作用(占总数的22%)则是在地塞米松处理后消失的。
在重要的地塞米松诱导环中,将GR结合增强子与GR靶基因Fkbp5和Tsc22D3联系起来,NIPBL和SMC1A以地塞米松依赖性的方式结合了这些增强子-启动子接触,
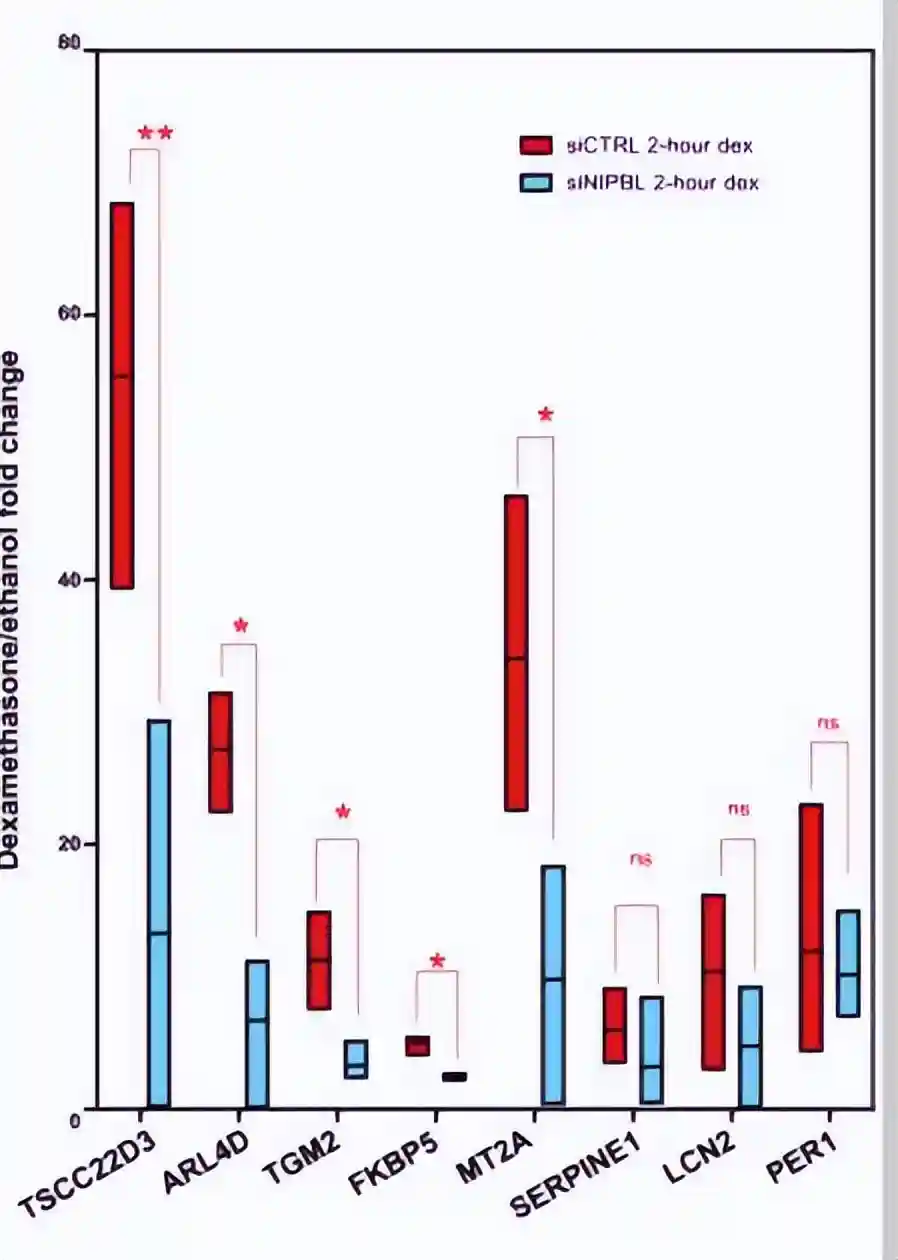
这些位点的TAD边界在地塞米松治疗之前已经形成,地塞米松的激活既诱导增强子环的形成,也促进了遗传资源位点与TAD边界连接的大部分结构条纹的形成。
结构条纹与环挤出过程相关,其中环锚以高频与整个结构域相互作用,从而激活靶基因的活性,
为了准确地识别这些特征,我们使用了Stripenn来分析Micro-C数据,在5000碱基对(bp)的分辨率下,在对照的EtOH样本中鉴定出了2300条结构条纹。
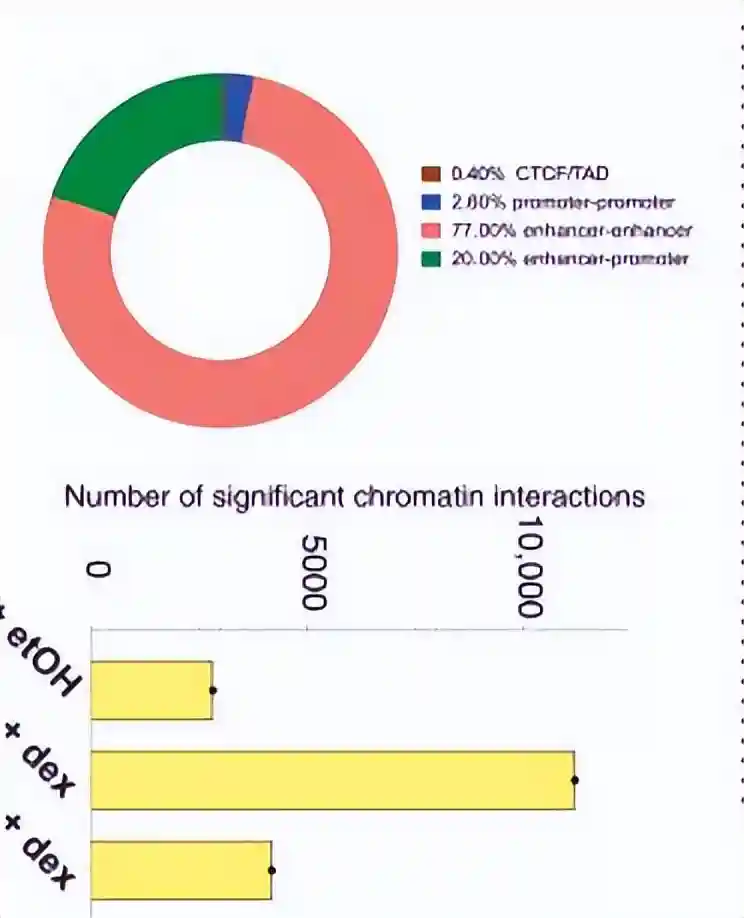
而在对照的地塞米松样本中则鉴定出了1703条,NIPBL将这些条纹数量减少到1157条,而上调则增至557条,
共有561条建筑条纹(分辨率为5kb)与遗传资源特异性地结合,与对照的EtOH相比,地塞米松处理显著增强了GR结合的建筑条纹,表明GR染色质结合促进更高的相互作用频率。
这种地塞米松诱导的建筑条纹激活在NIPBL敲低后丧失,GR和NIPBL通过形成增强子-启动子接触和结构条纹来促进DNA挤出。
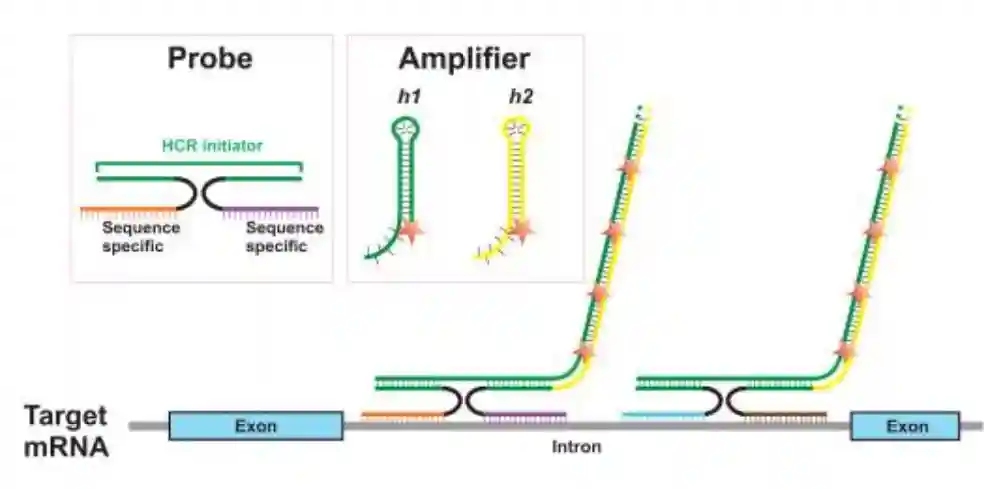
«——【·单分子新生RNA-FISH·】——»
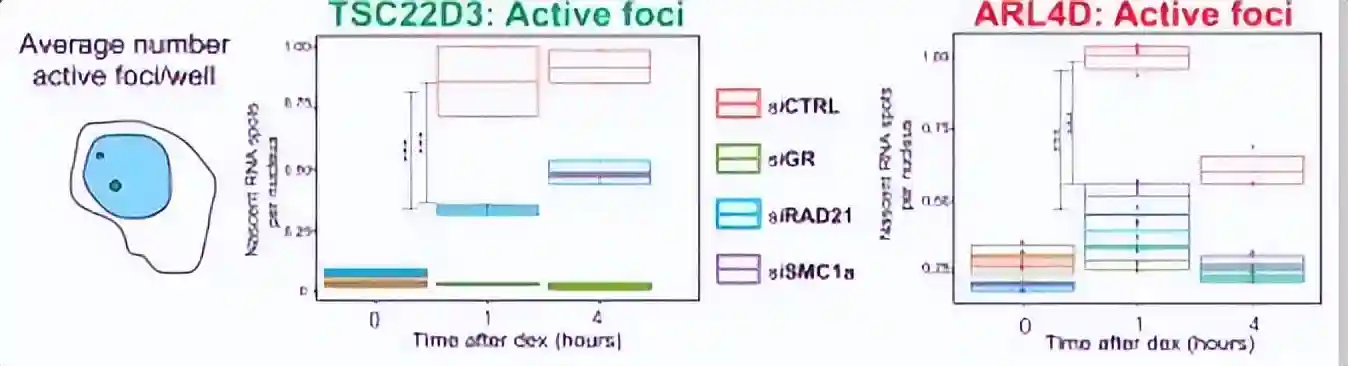
为了准确地研究凝聚素丧失对基因表达的影响,采用了高通量版本的杂交链反应(HCR)RNA荧光原位杂交(FISH)技术,来探测已知的GR靶基因Tsc22d3和Arl4d在单细胞水平上的表达变化。
通过使用HCR,我们能够在单个细胞和单等位基因水平上研究基因表达的分布,在加扰siRNA处理的细胞中,约65%的检测靶基因具有主动转录。
而在siSMC1a和siRAD21处理的细胞中,这个比例不到40%。
进一步研究了凝聚素的丧失是否会影响非诱导性转录因子的染色质结合,通过进行YY1的ChIP-seq实验来研究,YY1是一种已知结合和调节远程调节元件的非诱导性转录因子。
经过生长素处理24小时后,YY1的结合基本上没有受到影响,这证实了凝聚素复合物的丧失对于这种稳定结合的转录因子没有影响。
为了探究整体染色质可及性和组蛋白乙酰化是否因RAD21的急性耗竭而发生改变,我们进行了ATAC-seq和H3K27acChIP-seq实验(两个独立的生物学重复)。
RAD21的急性耗竭(4至24小时)显示染色质可及性和组蛋白乙酰化发生了微小的变化。
这表明稳态转录机制在很大程度上没有受到RAD21急性丧失的影响,长时间的凝聚素剥夺(72小时)导致了活性染色质修饰和凝聚素相关蛋白的丧失。
正如预测的,生长素处理后,TNF-α诱导的基因反应发生了变化,即诱导性转录因子NF-kB需要凝聚素来适当地调节基因表达。
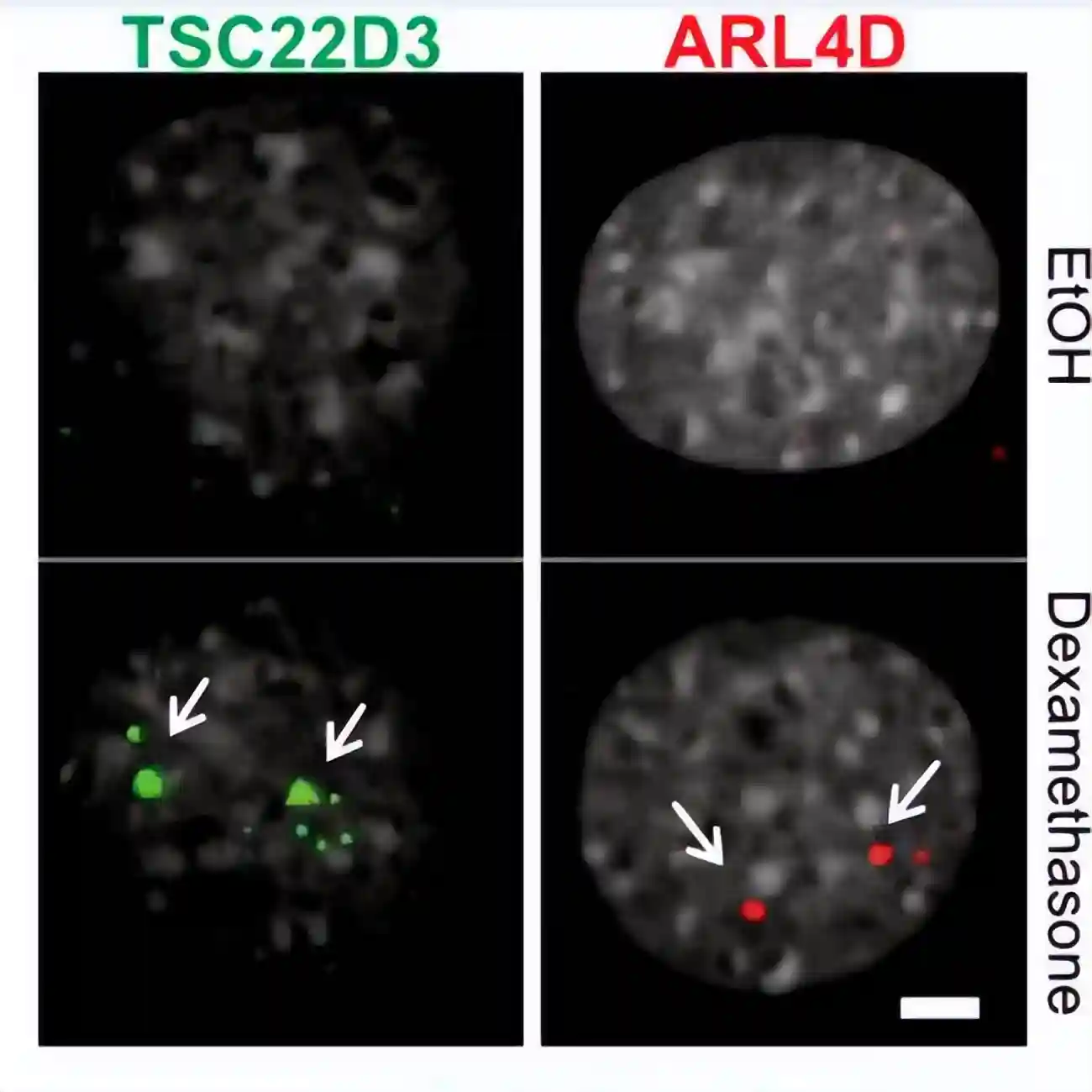
大多数TNF-α上调的基因在未处理和生长素处理的细胞中都有不同的调控,在RAD21耗竭的细胞中,没有超过21%的TNF-α下调基因。
这表明凝聚素在调节基因抑制方面具有重要作用,RAD21耗竭后,TNF治疗引发的所有基因的对数倍诱导都受到损害,这表明凝聚素复合物在微调基因激活和基因抑制方面发挥着关键作用。
在用细菌脂多糖(LPS)处理的情况下,凝聚素复合物如何在造血干细胞分化和自我更新过程中调节基因表达。
CTCF的缺失并没有改变巨噬细胞中LPS处理介导的基因表达,这表明内聚素在调节基因表达方面独立于TAD边界与CTCF的相互作用。
«——【·结论·】——»
我们的研究揭示了在AML细胞系中,糖皮质激素(GC)刺激的调节依赖于粘连素复合物的状态,这些细胞系具有粘连素基因突变的高发生率。
此外,研究表明Rad21耗竭细胞的NF-kB基因调控受到阻碍,这表明凝聚素与更大的转录因子组相互作用。
鉴于可能存在凝聚素突变,以考虑在评估糖皮质激素和/或细胞因子治疗的潜在益处时,综合考虑凝聚素的作用。
参考文献
【1】,《空间基因组组织中变异性的分子基础和生物学功能》
【2】KimS.,《转录因子与3D基因组之间的相互作用机制》
【3】SzaboQ.,《单细胞基因组组织调节为TAD和染色质纳米结构域》.
【4】,《人类凝聚素通过环挤出压缩DNA》